联合共建:深圳市卫生健康委员会、深圳市卫生健康发展研究和数据管理中心
电话:0755-2220 9945地址:深圳市福田区香蜜湖街道安托山一路2号(侨香办公区)及深圳市福田区园岭五街8号(园岭办公区)
粤ICP备15085268号-1粤公网安备 44030402002917号 网站标识码:4403000056
一、伦理审查申请/报告的类别
1.初始审查
初始审查申请:研究实施开始前应向伦理委员会递交初始审查申请,伦理委员会审查同意后研究方可实施。送审责任者在申请初始审查前应填写《初始审查申请表》,并根据审查材料清单准备送审文件。
2.跟踪审查
年度/定期跟踪审查: 伦理委员会在初始审查时应根据研究的风险程度、研究周期决定年度/定期跟踪审查频率,且应满足至少每年一次。研究过程中,伦理委员会应动态评估研究风险与获益,以确定跟踪审查频率是否需要改变。 伦理委员会办公室应在年度/定期跟踪审查到期日前 1 个月提醒研究者提交申请,接收《年度/定期跟踪审查申请表》、研究进展报告、项目年度报告、本机构发生的严重不良事件列表(如有)、 发表文章(如有)等材料。
修正案审查: 研究实施过程中,经伦理委员会批准的研究材料发生变动的,研究者应向伦理委员会提交修正案审查申请,经伦理审查同意后,方可实施。需送审责任者提交《修正案审查评审表》和修正材料。
严重不良事件和非预期事件报告审查:研究实施过程中发生的严重不良事件和需要报告的非预期事件的,研究者应及时按方案要求向伦理委员会报告,并提交 《严重不良事件或非预期事件审查申请表》和《严重不良事件报告表》。
不依从/违背方案事件审查: 研究实施过程中,出现未遵循国内相关法规开展研究,或研究违背伦理委员会批准版本方案的事件,研究者应在获知相关事件发生后及时向伦理委员会报告,并提交《不依从/违背方案审查申请表》。
暂停或终止已批准研究审查: 研究实施过程中,项目需要暂停或终止的,研究者应及时向伦理委员会报告,并制定相应的受试者保护计划,向伦理委员会提交《暂停/终止研究审查申请表》。
结题审查:研究结束后,研究者应及时向伦理委员会提交《结题报告审查申请表》。
3.复审申请
复审审查:上述初始审查和跟踪审查后,按伦理审查意见“修改后同意”,对方案进行修改后,应以“复审申请”的方式再次送审,经伦理委员会批准后方可实施;如果对伦理审查意见有不同的看法,可以“复审申请”的方式申诉不同意见,请伦理委员会重新考虑决定。
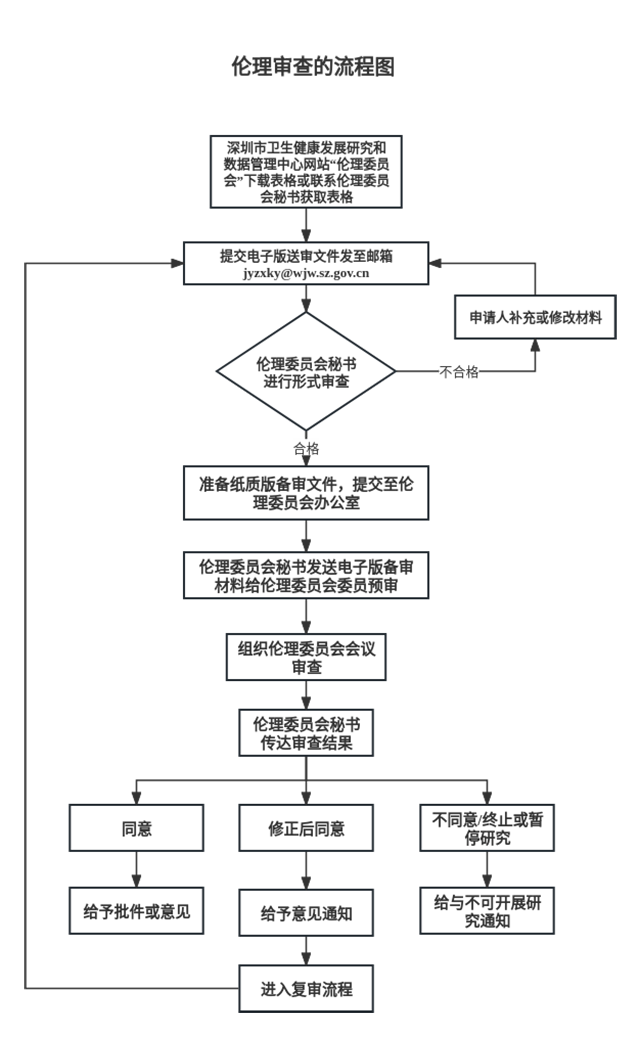
二、提交伦理审查流程
1.送审
送审责任者:临床研究项目的送审责任者一般为主要研究者/项目负责人;新药和医疗器械临床试验需送审材料一般由申办者准备;多中心临床试验的研究进展报告由申办者负责送审。
准备送审文件:根据送审文件清单,准备送审文件。
填写申请表格:根据伦理审查申请/报告的类别,填写相应的“申请表”(初始审查申请,修正案审查申请,年度/定期跟踪审查申请,严重不良事件申请表,违背方案申请表,暂停/终止研究申请表,结题报告审查申请表)等。
提交:电子版和纸质版申请表各一份提交给伦理委员会秘书。
2.通知
补充/修改送审材料通知:医学伦理委员会受理后,如果认为送审文件不完整,文件要素有缺陷,发送补充/修改送审材料通知,告知缺项文件、缺陷的要素,以及送审截止日期。
受理通知:送审文件的完整性和要素通过形式审查,秘书发送受理通知,并告知预定审查日期和预定审查地点。
三、审查时间
伦理委员会受理送审后,一般需要1周的时间进行处理,然后召开审查会议,具体时间以通知为准。一般情况下医学伦理委员会每季度召开一次审查会议,需要时可增加审查会议次数。
研究过程中出现重大或严重问题,突发公共事件,危及受试者安全时,或发生其他需要伦理委员会召开会议进行紧急审查和决定的情况,伦理委员会将召开紧急会议进行审查。
四、审查决定传达
伦理审查决定形成后5个工作日内,以“深圳市健研数管中心伦理审查批准件”的书面形式传达审查决定。对伦理审查决定有不同意见,可以向伦理委员会提交复审申请,与伦理委员会委员和办公室交流沟通。